luni, 17 decembrie 2012
vineri, 14 decembrie 2012
Fizicieni celebri
 Albert Einstein
(n. 14 martie 1879, Ulm -d. 18aprilie 1955, Princeton) a fost
un fizician german, apatrid din 1896, elveţian din 1899, emigrat în
1933 în SUA, naturalizat american în 1940, profesor universitar la
Berlin şi Princeton. Autorul teoriei relativităţii. În 1921 i s-a
decernat Premiul Nobel pentru Fizică. Cele mai multe dintre
contribuţiile sale în fizică sunt legate de teoria relativităţii
restrânse (1905), care unesc mecanica cu electromagnetismul, şi de
teoria relativităţii generalizate (1915) care extinde principiul
relativităţii mişcării neuniforme, elaborând o nouă teorie a
gravitaţiei.
Albert Einstein
(n. 14 martie 1879, Ulm -d. 18aprilie 1955, Princeton) a fost
un fizician german, apatrid din 1896, elveţian din 1899, emigrat în
1933 în SUA, naturalizat american în 1940, profesor universitar la
Berlin şi Princeton. Autorul teoriei relativităţii. În 1921 i s-a
decernat Premiul Nobel pentru Fizică. Cele mai multe dintre
contribuţiile sale în fizică sunt legate de teoria relativităţii
restrânse (1905), care unesc mecanica cu electromagnetismul, şi de
teoria relativităţii generalizate (1915) care extinde principiul
relativităţii mişcării neuniforme, elaborând o nouă teorie a
gravitaţiei.Maria Skłodowska-Curie, cunoscută şi ca Marie Curie, după numele său francez (n. 7 noiembrie 1867, Varşovia; d. 4 iulie 1934, Sancellemoz, Franţa) a fost o savantă poloneză stabilită în Franţa, dublu laureată a Premiului Nobel. A fost prima femeie care a primit un premiu Nobel şi singurul savant care a primit două premii Nobel în două domenii ştiinţifice diferite (fizică şi chimie). A introdus în fizică termenul de radioactivitate. Este cunoscută pentru cercetările sale în domeniul elementelor radioactive, al radioactivităţii naturale şi al aplicaţiilor acestora în medicină. A fost soţia unui laureat al Premiului Nobel, fizicianul Pierre Curie, şi mama unei laureate a Premiului Nobel (Irène Joliot-Curie). Cu excepţia fiicei sale Ève Curie (scriitoare), toţi descendenţii săi vor urma cariere ştiinţifice.
 Isaac Newton (n.
4 ianuarie 1643, Woolsthrope, Grantham, d. 31 martie 1727, Kensington,
Londra) a fost un renumit om de ştiinţă englez, matematician, fizician
şi astronom, preşedinte al Royal Society. Isaac Newton este savantul
aflat la originea teoriilor ştiinţifice care vor revoluţiona ştiinţa, în
domeniul opticii, matematicii şi în special al mecanicii. În 1687 a
publicat lucrarea Philosophiae Naturalis Principia Mathematica, în care a
descris Legea atracţiei universale şi, prin studierea legilor mişcării
corpurilor, a creat bazele mecanicii clasice. A contribuit, împreună cu
Gottfried Wilhelm von Leibniz, la inventarea şi dezvoltarea calculului
diferenţial şi a celui integral.Newton a fost un fizician, înainte de
toate. Laboratorul său uriaş a fost domeniul astronomiei, iar
instrumentele sale geniale au fost metodele matematice, unele dintre ele
inventate de el însuşi. Newton nu s-a lăsat antrenat de latura pur
astronomică şi matematică a activităţii sale, ci a rămas de preferinţă
fizician. În aceasta constă neobişnuita tenacitate şi economia gândirii
sale. Până la Newton şi după el, până în timpurile noastre, omenirea n-a
cunoscut o manifestare a geniului ştiinţific, de o forţă şi o durată
mai mare.
Isaac Newton (n.
4 ianuarie 1643, Woolsthrope, Grantham, d. 31 martie 1727, Kensington,
Londra) a fost un renumit om de ştiinţă englez, matematician, fizician
şi astronom, preşedinte al Royal Society. Isaac Newton este savantul
aflat la originea teoriilor ştiinţifice care vor revoluţiona ştiinţa, în
domeniul opticii, matematicii şi în special al mecanicii. În 1687 a
publicat lucrarea Philosophiae Naturalis Principia Mathematica, în care a
descris Legea atracţiei universale şi, prin studierea legilor mişcării
corpurilor, a creat bazele mecanicii clasice. A contribuit, împreună cu
Gottfried Wilhelm von Leibniz, la inventarea şi dezvoltarea calculului
diferenţial şi a celui integral.Newton a fost un fizician, înainte de
toate. Laboratorul său uriaş a fost domeniul astronomiei, iar
instrumentele sale geniale au fost metodele matematice, unele dintre ele
inventate de el însuşi. Newton nu s-a lăsat antrenat de latura pur
astronomică şi matematică a activităţii sale, ci a rămas de preferinţă
fizician. În aceasta constă neobişnuita tenacitate şi economia gândirii
sale. Până la Newton şi după el, până în timpurile noastre, omenirea n-a
cunoscut o manifestare a geniului ştiinţific, de o forţă şi o durată
mai mare. Savantul grec Arhimede
(în greacă Αρχιμήδης Arhimedes; n. aprox. 287 î.Hr. în Siracusa, atunci
colonie grecească, d. 212 î.Hr.) a fost unul dintre cei mai de seamă
învăţaţi ai lumii antice. Realizările sale se înscriu în numeroase
domenii ştiinţifice: matematică, fizică, astronomie, inginerie şi
filozofie. Carl Friedrich Gauss considera că Arhimede şi Isaac Newton au
fost cei mai mari oameni de ştiinţă din întreaga istorie a civilizaţiei
umane.Din operele lui au fost păstrate un număr relativ mare de
lucrări. Printre acestea se află şi Despre sferă şi cilindruîn care
Arhimede demonstrează că raportul dintre aria unei sfere şi cea a
cilindrului circumscris este egală cu raportul dintre volumele celor
două corpuri (şi anume exact 2/3), rezultat de care Arhimede se pare că
era foarte mândru. A pus la punct o metodă de a calcula numărul π
(raportul dintre circumferinţa şi diametrul unui cerc) cu o precizie
oricât de bună, bazată pe calculul perimetrelor unor perechi de
poligoane regulate, unul înscris în cerc şi altul circumscris, cu număr
crescător de laturi. Pentru cazul când numărul laturilor este 96,
Arhimede a calculat o aproximaţie a numărului π între 223/71
(aproximativ 3,1408) şi 22/7 (aproximativ 3,1429).
Savantul grec Arhimede
(în greacă Αρχιμήδης Arhimedes; n. aprox. 287 î.Hr. în Siracusa, atunci
colonie grecească, d. 212 î.Hr.) a fost unul dintre cei mai de seamă
învăţaţi ai lumii antice. Realizările sale se înscriu în numeroase
domenii ştiinţifice: matematică, fizică, astronomie, inginerie şi
filozofie. Carl Friedrich Gauss considera că Arhimede şi Isaac Newton au
fost cei mai mari oameni de ştiinţă din întreaga istorie a civilizaţiei
umane.Din operele lui au fost păstrate un număr relativ mare de
lucrări. Printre acestea se află şi Despre sferă şi cilindruîn care
Arhimede demonstrează că raportul dintre aria unei sfere şi cea a
cilindrului circumscris este egală cu raportul dintre volumele celor
două corpuri (şi anume exact 2/3), rezultat de care Arhimede se pare că
era foarte mândru. A pus la punct o metodă de a calcula numărul π
(raportul dintre circumferinţa şi diametrul unui cerc) cu o precizie
oricât de bună, bazată pe calculul perimetrelor unor perechi de
poligoane regulate, unul înscris în cerc şi altul circumscris, cu număr
crescător de laturi. Pentru cazul când numărul laturilor este 96,
Arhimede a calculat o aproximaţie a numărului π între 223/71
(aproximativ 3,1408) şi 22/7 (aproximativ 3,1429). André-Marie Ampère (20 ianuarie 1775 – 10 iunie 1836), a fost un
André-Marie Ampère (20 ianuarie 1775 – 10 iunie 1836), a fost unfizician şi matematician francez. Este considerat unul dintre principalii fondatori ai electromagnetismului.Face studii privind interacţiunea reciprocă a curenţilor şi magneţilor, apoi a curenţilor asupra câmpului magnetic al selenoidului. Stabileşte expresia matematică a forţei electrodinamice (1820). De asemeni a determinat configuraţia curenţilor asupra câmpului magnetic al selenoidului, stabilind regula de fixare a sensului liniilor de câmp.Introduce noţiunea de curent electric şi tensiune electrică.Explică magnetismul corpurilor printr-o ipoteză care arată că forma curenţilor moleculari este presupusă a fi circulară.
Prin legea circuitului magnetic sau legea circuitală a lui Ampère, stabileşte prima teorie a electromagnetismului şi introduce noţiunile de electrostatică şi electromagnetism. Această lege stabileşte legătura dintre câmpul magnetic şi curent.Inventează galvanometrul, aparatul cu care pot fi măsurate tensiunile electrice şi curentul electric. Inventează de asemeni un electromagnet şi împreună cu D.F.J. Arago realizează în 1820, primul aparat telegrafic.
marți, 11 decembrie 2012
luni, 10 decembrie 2012
Demonul lui Maxwell
Demonul lui Maxwell este un experiment mental formulat de fizicianul scoţian James Clerk Maxwell,
ce-şi propunea să “demonstreze că a doua lege a termodinamicii este
certă numai din punct de vedere statistic”, fiind utilizat ca
instrument de prezentare a posibilităţii de încălcare a acestei legi.
Conceptul a apărut pentru prima dată într-o scrisoare pe care Maxwell a
scris-o lui Peter Guthrie Trait pe 1 Decembrie 1867, mai apoi într-o
scrisoare adresată lui John William Strutt în 1870, cu puţin timp
înainte de a fi dezvăluit publicului în cartea sa din 1871, Teoria Căldurii.
Experimentul implică un container teoretic împărţit în două părţi separate de o uşă, ce poate fi deschisă şi închisă de o singură entitate. Entitatea a fost mai târziu denumită “Demonul lui Maxwell” de către William Thomson, Lord Kelvin, cel care a elaborat experimentul lui Maxwell.

Figură shematică a demonului lui Maxwell
Cu alte cuvinte, Maxwell îşi imaginează un singur container împărţit în două părţi, A şi B. Ambele sunt umplute cu acelaşi timp de gaz, la temperaturi egale şi plasate una lângă cealaltă. Observând moleculele de pe ambele părţi, un demon imaginar păzeşte portiţa ce departajează cele două părţi. Când o moleculă peste medie de rapidă din A zboară spre portiţa ce departajează cele două părţi, demonul o deschide, iar molecula va trece din A în B. Viteza medie a moleculelor din B va creşte în timp ce viteza medie a moleculelor din A va scădea. Din moment ce viteza moleculară medie corespunde cu temperatura, temperatura scade în A şi creşte în B, ceea ce contrazice a doua lege a termodinamicii.
Originea termenului
Când Maxwell a introdus acest concept în scrisorile sale către colegi şi în cartea sa, Teoria Căldurii, l-a descris ca fiind o “fiinţă desăvârşită”. William Thompson (Lord Kelvin) a fost primul care a denumit conceptul lui Maxwell “demon”, în periodicul Nature, în 1874, spunând că a folosit acest cuvant pentru a sugerea mai degrabă grandoarea fiinţei, decât aspectul malefic.
Critică şi dezvoltare
Mai mulţi fizicieni au prezentat calcule prin care arată că a doua lege a fizicii nu este de fapt violată prin experimentul mental al lui Maxwell, dacă se realizează o analiză mai completă a întregului sistem, inclusiv a demonului. Scopul argumentului fizic este de a arăta prin calcule că orice demon trebuie să “genereze” mai multă entropie pentru a separa moleculele decât ar putea vreodată elimina prin metoda descrisă. Adică, a măsura viteza moleculelor şi a le permite selectiv să treacă prin deschiderea dintre A şi B ar solicita mai mult efort decât cantitatea de energie conţinută de diferenţa de temperatură cauzată.
Unul dintre cele mai faimoase replici la această întrebare a fost sugerată în 1929 de Leo Szilard şi mai târziu de Leon Brillouin. Szillard a arătat că un demon de-al lui Maxwell proiectat în realitate ar avea nevoie de instrument de măsură a vitezei moleculare, iar actul în sine de a asimila informaţii ar necesita o cheltuială de energie. A doua lege spune că entropia totală a unui sistem izolat trebuie să crească. Din moment ce demonul şi gazul interacţionează, trebuie să luăm în considerare entropia totală a gazului şi a demonului combinate. Cheltuiala de energie a demonului va cauza o creştere a entropiei demonului, care va fi mai mare decât scăderea entropiei gazului. De exemplu, dacă demonul verifică poziţia moleculară folosind o lanternă, bateria de la lanternă este un dispozitiv de entropie scăzută, o reacţie chimică ar fi pe punctul de a se declanşa. Pe măsură ce energia este consumată emiţând fotoni (a căror entropie trebuie deasemenea luată în considerare), reacţia chimică a bateriei va continua şi entropia sa va scădea, mai mult decât compensând scăderea entropiei gazului.
În 1960, Rolf Landauer a prezentat o excepţie a acestui argument. Acesta a realizat că unele procese de măsurare nu necesită creşterea entropiei termodinamice, atâta timp cât acestea sunt reversibile din punct de vedere termodinamic. Acesta a sugerat că măsurătorile “reversibile” ar putea fi folosite pentru a selecţiona moleculele, contrazicând a doua lege. Cu toate acestea, datorită conexiunii între entropia termodinamică şi entropia informaţiei, măsurătoarea înregistrată nu trebuie ştearsă. Cu alte cuvinte, pentru a determina pe ce parte trebuie să se situeze o moleculă, demonul trebuie să asimileze informaţii despre starea moleculei pe care să o şteargă sau să o stocheze. Înlăturarea informaţiei ar duce la creşterea imediată a entropiei, dar demonul nu o pate stoca la indinit. În 1982 Bennet a arătat că, oricât de bine pregătit, acest demon va rămâne fără spaţiu de stocare a informaţiei şi va trebui să înceapă să şteargă informaţia acumulată în prealabil. Ştergerea informaţiei este un proces termodinamic ireversibil ce creşte entropia unui sistem.
A se nota că dacă întreg universul ar fi constituit dintr-un demon şi un container, şi energia ar fi necesară pentru a opera portiţa de acces, singura sursă de energie ar fi permiterea căldurii să circule din B în A. Acum, cuantumul circulaţiei de energie de la B la A este o singură particulă mergând de la B la A. Aceasta reface entropia, deoarece particulele singulare ce merg de la B la A sunt în medie mai energetice decât cele ce merg de la A la B.
Argumentul de mai sus poate lua o altă formă dacă uşa este repzentată ca şi o potenţială barieră energetică. Pentru a creşte potenţialul, munca trebuie depusă, iar acel vârf de energie potenţială va trebui să fie mai mare decât energia kinetică a particulei mergând de la A la B. Astfel, cuantumul circulaţiei de energie de la B la A ar trebui să fie mai energetic decât particula ce intră.
Cu toate acestea, John Earman şi John Norton au argumentat că interpretările lui Szilard şi Landauer asupra demonului lui Maxwell pornesc de la ipoteza că a doua lege a termodinamicii nu poate fi încălcată, prezentând astfel dovezi că demonul lui Maxwell nu poate încălca circular cea de-a doua lege.
Experimentul implică un container teoretic împărţit în două părţi separate de o uşă, ce poate fi deschisă şi închisă de o singură entitate. Entitatea a fost mai târziu denumită “Demonul lui Maxwell” de către William Thomson, Lord Kelvin, cel care a elaborat experimentul lui Maxwell.
A doua lege a termodinamicii spune că
atunci când două corpuri de temperaturi diferite intră în contact,
fiind izolate de restul universul, acestea vor evolua într-un echilibru
termodinamic în care ambele vor avea aproximativ aceeaşi temperatură. O
formulare echivalentă a principiului este: în decursul oricărui proces
natural entropia unui sistem izolat termic nu poate să scadă.
Maxwell a conceput un experiment mental ca şi instrument de înţelegere aprofundată a celei de-a doua legi. El a descris experimentul astfel: ...dacă ne imaginăm o fiinţă atât de abilă încât poate urma fiecare moleculă pe traiectoria sa, atunci o astfel de fiinţă, a cărei atribute sunt într-atât de desăvârşite ca şi ale noastre, ar fi capabilă de a face ceea ce nouă ne este imposibil. Deoarece noi am văzut că moleculele dintr-un recipient plin cu aer de o temperatură uniformă se mişcă cu velocităţi cu totul neuniforme, deşi forma de velocitate a oricărui număr din ele, selectate arbitrar, este aproape identic uniformă. Să presupunem că un astfel de vas se divide în două porţiuni, A şi B, de o diviziune cu un mic orificiu şi că o fiinţă poate observa moleculele individuale, astfel încât numai moleculele rapide să treacă de la A la B, şi numai cele mai lente să treacă de la B la A. Astfel, el va reuşi , fără surplus de efort, să crească temperatura lui B şi să o scadă pe cea a lui A, în contradiţie cu cea de-a doua lege a termodinamicii...
Maxwell a conceput un experiment mental ca şi instrument de înţelegere aprofundată a celei de-a doua legi. El a descris experimentul astfel: ...dacă ne imaginăm o fiinţă atât de abilă încât poate urma fiecare moleculă pe traiectoria sa, atunci o astfel de fiinţă, a cărei atribute sunt într-atât de desăvârşite ca şi ale noastre, ar fi capabilă de a face ceea ce nouă ne este imposibil. Deoarece noi am văzut că moleculele dintr-un recipient plin cu aer de o temperatură uniformă se mişcă cu velocităţi cu totul neuniforme, deşi forma de velocitate a oricărui număr din ele, selectate arbitrar, este aproape identic uniformă. Să presupunem că un astfel de vas se divide în două porţiuni, A şi B, de o diviziune cu un mic orificiu şi că o fiinţă poate observa moleculele individuale, astfel încât numai moleculele rapide să treacă de la A la B, şi numai cele mai lente să treacă de la B la A. Astfel, el va reuşi , fără surplus de efort, să crească temperatura lui B şi să o scadă pe cea a lui A, în contradiţie cu cea de-a doua lege a termodinamicii...

Figură shematică a demonului lui Maxwell
Cu alte cuvinte, Maxwell îşi imaginează un singur container împărţit în două părţi, A şi B. Ambele sunt umplute cu acelaşi timp de gaz, la temperaturi egale şi plasate una lângă cealaltă. Observând moleculele de pe ambele părţi, un demon imaginar păzeşte portiţa ce departajează cele două părţi. Când o moleculă peste medie de rapidă din A zboară spre portiţa ce departajează cele două părţi, demonul o deschide, iar molecula va trece din A în B. Viteza medie a moleculelor din B va creşte în timp ce viteza medie a moleculelor din A va scădea. Din moment ce viteza moleculară medie corespunde cu temperatura, temperatura scade în A şi creşte în B, ceea ce contrazice a doua lege a termodinamicii.
Originea termenului
Când Maxwell a introdus acest concept în scrisorile sale către colegi şi în cartea sa, Teoria Căldurii, l-a descris ca fiind o “fiinţă desăvârşită”. William Thompson (Lord Kelvin) a fost primul care a denumit conceptul lui Maxwell “demon”, în periodicul Nature, în 1874, spunând că a folosit acest cuvant pentru a sugerea mai degrabă grandoarea fiinţei, decât aspectul malefic.
Critică şi dezvoltare
Mai mulţi fizicieni au prezentat calcule prin care arată că a doua lege a fizicii nu este de fapt violată prin experimentul mental al lui Maxwell, dacă se realizează o analiză mai completă a întregului sistem, inclusiv a demonului. Scopul argumentului fizic este de a arăta prin calcule că orice demon trebuie să “genereze” mai multă entropie pentru a separa moleculele decât ar putea vreodată elimina prin metoda descrisă. Adică, a măsura viteza moleculelor şi a le permite selectiv să treacă prin deschiderea dintre A şi B ar solicita mai mult efort decât cantitatea de energie conţinută de diferenţa de temperatură cauzată.
Unul dintre cele mai faimoase replici la această întrebare a fost sugerată în 1929 de Leo Szilard şi mai târziu de Leon Brillouin. Szillard a arătat că un demon de-al lui Maxwell proiectat în realitate ar avea nevoie de instrument de măsură a vitezei moleculare, iar actul în sine de a asimila informaţii ar necesita o cheltuială de energie. A doua lege spune că entropia totală a unui sistem izolat trebuie să crească. Din moment ce demonul şi gazul interacţionează, trebuie să luăm în considerare entropia totală a gazului şi a demonului combinate. Cheltuiala de energie a demonului va cauza o creştere a entropiei demonului, care va fi mai mare decât scăderea entropiei gazului. De exemplu, dacă demonul verifică poziţia moleculară folosind o lanternă, bateria de la lanternă este un dispozitiv de entropie scăzută, o reacţie chimică ar fi pe punctul de a se declanşa. Pe măsură ce energia este consumată emiţând fotoni (a căror entropie trebuie deasemenea luată în considerare), reacţia chimică a bateriei va continua şi entropia sa va scădea, mai mult decât compensând scăderea entropiei gazului.
În 1960, Rolf Landauer a prezentat o excepţie a acestui argument. Acesta a realizat că unele procese de măsurare nu necesită creşterea entropiei termodinamice, atâta timp cât acestea sunt reversibile din punct de vedere termodinamic. Acesta a sugerat că măsurătorile “reversibile” ar putea fi folosite pentru a selecţiona moleculele, contrazicând a doua lege. Cu toate acestea, datorită conexiunii între entropia termodinamică şi entropia informaţiei, măsurătoarea înregistrată nu trebuie ştearsă. Cu alte cuvinte, pentru a determina pe ce parte trebuie să se situeze o moleculă, demonul trebuie să asimileze informaţii despre starea moleculei pe care să o şteargă sau să o stocheze. Înlăturarea informaţiei ar duce la creşterea imediată a entropiei, dar demonul nu o pate stoca la indinit. În 1982 Bennet a arătat că, oricât de bine pregătit, acest demon va rămâne fără spaţiu de stocare a informaţiei şi va trebui să înceapă să şteargă informaţia acumulată în prealabil. Ştergerea informaţiei este un proces termodinamic ireversibil ce creşte entropia unui sistem.
A se nota că dacă întreg universul ar fi constituit dintr-un demon şi un container, şi energia ar fi necesară pentru a opera portiţa de acces, singura sursă de energie ar fi permiterea căldurii să circule din B în A. Acum, cuantumul circulaţiei de energie de la B la A este o singură particulă mergând de la B la A. Aceasta reface entropia, deoarece particulele singulare ce merg de la B la A sunt în medie mai energetice decât cele ce merg de la A la B.
Argumentul de mai sus poate lua o altă formă dacă uşa este repzentată ca şi o potenţială barieră energetică. Pentru a creşte potenţialul, munca trebuie depusă, iar acel vârf de energie potenţială va trebui să fie mai mare decât energia kinetică a particulei mergând de la A la B. Astfel, cuantumul circulaţiei de energie de la B la A ar trebui să fie mai energetic decât particula ce intră.
Cu toate acestea, John Earman şi John Norton au argumentat că interpretările lui Szilard şi Landauer asupra demonului lui Maxwell pornesc de la ipoteza că a doua lege a termodinamicii nu poate fi încălcată, prezentând astfel dovezi că demonul lui Maxwell nu poate încălca circular cea de-a doua lege.
sâmbătă, 8 decembrie 2012
Transformarea izobara
O transformare izobară are loc la presiune constantă. Un exemplu de astfel de transformare apare într-un cilindru închis (sistem termodinamic izolat) în care pistonul se mișcă, însă presiunea din cilindru rămâne constantă, de exemplu presiunea atmosferică. Perechea de parametri conjugați semnificativă este p-V.
Numim transformare izobară transformarea pe parcursul căreia numărul de moli şi presiunea sistemului termodinamic rămân nemodificate.

În oricare stare de echilibru a gazului ideal, între parametrii care caracterizează starea acestuia există relaţia dată de ecuaţia de stare:

- Legea transformării izobare: Volumul gazului ideal este direct proporţională cu temperatura absolută a gazului.
 echivalent :
echivalent :
Un gaz ideal se află într−o stare iniţială, caracterizată de parametrii (p, V1, n, T1). Gazul participă la o transformare izobară până într−o stare finală, caracterizată de parametrii (p, V2, n, T2)

O transformare izobară a unui gaz ideal.
Dacă utilizezi forma
 a legii transformării izobare, obţii imediat:
a legii transformării izobare, obţii imediat:
Relaţia obţinută îţi permite să calculezi oricare dintre parametrii variabili ai gazului ideal, dacă îi cunoşti pe ceilalţi trei.
Legea transformării izobare a fost descoperită experimental de către francezul Jaques Charles, în 1787. Acesta a constatat că o serie de gaze (aer, oxigen, azot, hidrogen, dioxid de carbon) se dilată în aceleasi proporţii, pe un interval de 80°C. Rezultatele au fost publicate pentru prima dată în 1802 de către francezul Joseph Louis Gay−Lussac, care a descoperit şi dependenţa liniară dintre volum şi temperatură.
În cazul hidrogenului, la presiuni în jurul celei atmosferice normale şi temperaturi în intervalul 0°C...100°C, abaterile faţă de relaţia
 sunt mai mici de 0,5% .
sunt mai mici de 0,5% .Legea Gay – Lussac este legea transformării izobare (p=constant) a unei cantităţi constante (ν=constant) de gaz ideal.
Enunţ: Variaţia relativă a volumului unei cantităţi constante de gaz ideal, menţinut la presiune constantă, este direct proporţională cu temperatura .
unde: - V0 este volumul gazului la t0=0˚C
- V este volumul gazului la temperatura t
Observaţii:
1) Coeficientul de proporţionalitate α se numeşte coeficient de dilatare izobară.
2) Coeficientul de dilatare izobară are aceeaşi valoare pentru toate gazele:
Transformarea izocora
Transformarea izoterma
Definitie: Numim transformare izotermă transformarea pe parcursul căreia numărul de moli şi temperatura sistemului termodinamic rămân nemodificate.
În oricare stare de echilibru a gazului ideal, între parametrii care caracterizează starea acestuia există relaţia dată de ecuaţia de stare:
pV=nRT
Legea transformării izoterme: Presiunea gazului ideal este invers proporţională cu volumul gazului:
p = (nRT)*1/V
sau
pV=nRT=constant

Legea Boyle- Mariotte (legea transformarii izoterme)
Legea transformării izoterme a fost descoperită experimental în 1662 de către irlandezul Robert Boyle, cronologic, prima lege a gazelor care a fost descoperită.
Această lege arată cum variază presiunea unui gaz în funcție de volum într-o tranformare în care masa și temperatura gazului rămân constante, și se enunță astfel: Pentru o masă dată de gaz m, aflată la temperatură consatantă, T, produsul dintre presiunea gazului și volumul ocupat de acesta este constant:
P1V1=P2V2=PV=const (1)
Unde cu P1, V1, P2, V2 s-au notat valorile presiunii si respectiv ale volumului pentru două stari 1 si 2, ale gazului, care au aceeasi temperatură.
Din relatia (1) rezultă că la o temperatură dată stările posibile ale gazului reprezentate în coordonate (p,V) se plasează o hiperbolă echilateră.
Cu cât temperatura la care se efectuează transformarea este mai mare cu atât valoarea constantei din relatia (1) este mai mare si distanta izotermelor fată de originea axelor de coordonate (p, V) creste.
Relaţia obţinută permite să calculăm oricare dintre parametrii variabili ai gazului ideal, dacă îi cunoşti pe ceilalţi trei.
Într−o transformare izotermă, parametrii variabili sunt presiunea şi volumul gazului. Într−un sistem de axe, în care una dintre axe este presiunea, iar cealaltă este volumul, fiecărei stări a gazului îi corespunde un punct de coordonate (p, V), numite coordonate Clapeyron.
În coordonate p−V, reprezentarea grafică a unei transformări izoterme a gazului ideal este un arc de hiperbolă, simetrică faţă de prima bisectoare a sistemului de coordonate. Arcul de hiperbolă intersectează prima bisectoare mai departe de origine pentru o valoare mai mare a cantităţii constante din legea transformării izoterme.

În oricare stare de echilibru a gazului ideal, între parametrii care caracterizează starea acestuia există relaţia dată de ecuaţia de stare:
pV=nRT
Legea transformării izoterme: Presiunea gazului ideal este invers proporţională cu volumul gazului:
p = (nRT)*1/V
sau
pV=nRT=constant

Legea Boyle- Mariotte (legea transformarii izoterme)
Legea transformării izoterme a fost descoperită experimental în 1662 de către irlandezul Robert Boyle, cronologic, prima lege a gazelor care a fost descoperită.
Această lege arată cum variază presiunea unui gaz în funcție de volum într-o tranformare în care masa și temperatura gazului rămân constante, și se enunță astfel: Pentru o masă dată de gaz m, aflată la temperatură consatantă, T, produsul dintre presiunea gazului și volumul ocupat de acesta este constant:
P1V1=P2V2=PV=const (1)
Unde cu P1, V1, P2, V2 s-au notat valorile presiunii si respectiv ale volumului pentru două stari 1 si 2, ale gazului, care au aceeasi temperatură.
Din relatia (1) rezultă că la o temperatură dată stările posibile ale gazului reprezentate în coordonate (p,V) se plasează o hiperbolă echilateră.
Cu cât temperatura la care se efectuează transformarea este mai mare cu atât valoarea constantei din relatia (1) este mai mare si distanta izotermelor fată de originea axelor de coordonate (p, V) creste.
Relaţia obţinută permite să calculăm oricare dintre parametrii variabili ai gazului ideal, dacă îi cunoşti pe ceilalţi trei.
Într−o transformare izotermă, parametrii variabili sunt presiunea şi volumul gazului. Într−un sistem de axe, în care una dintre axe este presiunea, iar cealaltă este volumul, fiecărei stări a gazului îi corespunde un punct de coordonate (p, V), numite coordonate Clapeyron.
În coordonate p−V, reprezentarea grafică a unei transformări izoterme a gazului ideal este un arc de hiperbolă, simetrică faţă de prima bisectoare a sistemului de coordonate. Arcul de hiperbolă intersectează prima bisectoare mai departe de origine pentru o valoare mai mare a cantităţii constante din legea transformării izoterme.
 |
 |
 |
miercuri, 5 decembrie 2012
Aplicatii practice
Motoare termice cu ardere internă
Acestea sunt maşini termice în interiorul cărora arderea unui gaz combustibil conduce la obţinerea unei cantităţi de căldură cu realizarea unui lucru mecanic util la arborele maşinii. Pentru studiul unei astfel de maşini se utilizează ipotezele1. agentul de lucru din motor este un amestec de gaze arse care se consideră ca un gaz perfect;
2. pe durata efectuării unui ciclu se consideră căldura specifică a fi constantă cu temperatura;
3. agentul de lucru nu schimbă faza în timpul unui ciclu;
4. se consideră că pe parcursul unui ciclu cantitatea de agent termic rămâne constantă – dacă nu se consideră fazele de aspiraţie, refulare;
5. procesele din motorul termic sunt reversibile (comprimare şi destindere);
6. procesul complex al arderii combustibilului se înlocuieşte printr-o comunicare termodinamică de căldură.
După modul în care se realizează procesul de ardere a combustibilului motoarele cu ardere internă se clasifică în:
- cu ardere la volum constant – se aspiră un amestec format din aer şi vapori de combustibili care după comprimare se aprinde prin declanşarea unei scântei electrice MAS – motoare cu aprindere prin scânteie;
- cu ardere la presiune constantă – se aspiră aer care se comprimă şi la sfârşitul comprimării se injectează combustibil care se autoaprinde datorită faptului că aerul comprimat are o temperatură înaltă peste cea de aprindere a combustibilului – MAC – motor cu aprindere prin comprimare.
Motorul Diesel

- este un motor cu ardere interna, in patru timpi cu aprindere prin compresie;
- foloseste drept combustibil motorina;
- pompa de injectie produce presiunea combustibilului, iar injectorul il pulverizeaza in interiorul cilindrului
- randamentul motorului Diesel este superior motorului cu aprindere prin scanteie .
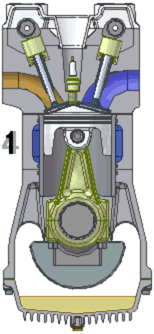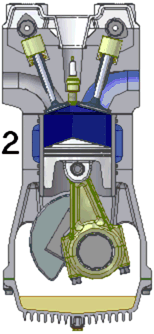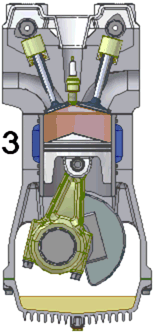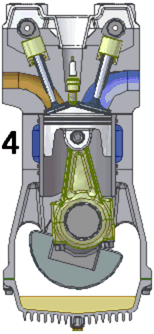
Cei 4 timpi de functionare ai motorului Diesel sunt:
1.Admisia
2.Compresia
3.Arderea si detenta
4.Evacuarea gazelor

Admisia
- supapa de admisie este deschisa, pistonul se deplaseaza in jos si in cilindru se aspira aer la presiune atmosferica;
- supapa de evacuare este inchisa;
- procesul are loc la presiune constanta
Compresia
- ambele supape sunt inchise;
- pistonul se deplaseaza in sus si aerul este puternic comprimat aproximativ 35-50 atm si temperatura este 700-800 ºC;
- procesul se desfasoara rapid, fara schimb de caldura.
Arderea si detenta
- pompa de injectie pulverizeaza picaturi foarte fine de motorina in cilindru;
- deoarece temperatura in cilindru este mai mare decat temperatura de aprindere a combustibilului, acesta se aprinde si arde la presiune constanta;
- gazele rezultate din ardere de destind adiabatic .
Evacuarea gazelor
- pompa de injectie pulverizeaza picaturi foarte fine de motorina in cilindru;
- deoarece temperatura in cilindru este mai mare decat temperatura de aprindere a combustibilului, acesta se aprinde si arde la presiune constanta;
- gazele rezultate din ardere de destind adiabatic .

Ciclul termodinamic al motorului Diesel

Funcţionarea unui motor modern, cu patru supape pentru fiecare cilindru şi injecţie de benzină.
Motorul Otto este astfel denumit dupa numele inventatorului sau Nikolaus August Otto
¨ Este un motor standard in patru timpi in care pistonul face 4 curse si foloseste drept combustibil un amestec de aer cu vapori de benzina.
¨ Amestecul este aspirat intr-un cilindru cu piston prin supapa de admisie
¨ Cu ajutorul unei bujii se produce o scantee, combustibilul arde, producand gaze care imping pistonul si efectueaza lucrul mecanic
¨ Pistonul este legat de un sistem biela-manivela care are rolul de a transforma miscarea rectilinie de dus-intors in miscare circulara continua
¨ Cei 4 timpi de functionare ai motorului Otto sunt:
1.Admisia
2.Compresia adiabatica
3.Arderea si destinderea adiabatica
4.Evacuarea
Admisia

¨ Pistonul porneste de la capatul superior al cilindrului si in cilindru este aspirat amestecul de aer si benzina supapa de admisie fiind deschisa ; la sfarsitul acestui timp pistonul ajunge la capatul inferior si supapa de admisie se inchide.
Compresia adiabatica

¨ Cand pistonul ajunge la capatul inferior, supapa de admisie se inchide si pistonul incepe sa urce in cilindru realizand o comprimare adiabatica a amestecului comburant
Arderea si destinderea adiabatica

¨ O descarcare electrica a bujiei aprinde amestecul comburant a carui ardere are loc rapid, ca o explozie. De aici provine si denumirea alternativa de motor cu explozie. Presiunea si temperatura in cilindru cresc brusc si pistonul este impins. Timpul 3 este timpul motor, in care se efectueaza lucru mecanic asupra pistonului. La sfarsitul acestui timp se deschide supapa de evacuare
Evacuarea

¨ Evacuarea gazelor arse, in atmosfera, incepe printr-un proces de racire izocora, pana cand gazele ajung la presiunea atmosferica. Pistonul se ridica si gazele sunt evacuate, supapa de evacuare fiind deschisa. La capatul ciclului supapa de evacuare se inchide iar supapa de admisie se deschide si incepe un nou ciclu.
¨ Prin supapa de evacuare se elimina gazele de ardere.
Primul motor Otto, din anul 1876

Motorul Otto in zilele noastre

marți, 4 decembrie 2012
Termodinamica

Termodinamica studiază procesele fizice care au loc în sisteme cu un număr foarte mare de particule, în care intervin şi fenomene termice. Un sistem termodinamic este o porţiune oarecare din Univers care poate interacţiona cu mediul înconjurător (exteriorul).
Un sistem este izolat dacă nu interacţionează cu exteriorul. Un sistem închis schimbă numai energie cu exteriorul. Un sistem este deschis dacă schimbă substanţă cu mediul
înconjurător.
Starea unui sistem termodinamic la un moment dat este determinată de un număr finit de parametri numiţi parametrii de stare. Presiunea şi volumul sunt parametri mecanici, iar temperatura este un parametru specific termodinamicii.Parametrii intensivi (presiunea, temperatura, concentraţia, tensiunea electrică etc.) nu depind de numărul de particule din sistem, având aceeaşi valoare pentru toate elementele constituiente ale sistemului. Parametrii extensivi (volumul, energia internă, entropia, sarcina electrică etc.) sunt proporţionali cu numărul de particule din sistem, fiind mărimi aditive.
Pentru a exprima lucrul mecanic elementar, asociem fiecărui contact (mecanic, electric,magnetic, chimic etc.) dintre sistem şi exterior o pereche de parametri – unii de forţă(exemplu: presiunea) şi alţii de poziţie (exemplu: volumul). Parametrii corespunzători contactului mecanic sînt presiunea şi volumul.
Starea de echilibru termodinamic este o stare în care parametrii de stare sunt constanţi în timp şi nu există fluxuri în interiorul sistemului.
Principiul general al termodinamicii (primul postulat) arată că dacă un sistem termodinamic izolat este perturbat la un moment dat, atunci după încetarea perturbaţiei sistemul evoluează spontan (de la sine) către o stare de echilibru termodinamic, pe care o atinge după un timp τ numit timp de relaxare. Sistemul nu poate ieşi niciodată de la sine din starea de echilibru termodinamic.Trecerea unui sistem dintr-o stare de echilibru termodinamic în altă stare de echilibru constituie un proces termodinamic.
Procesele termodinamice pot fi clasificate din mai multe puncte de vedere:
a) după legătura dintre starea finală şi cea iniţială, în:
- ciclice, când starea finală coincide cu starea iniţială;
- neciclice, când starea finală este diferită de starea iniţială.
b) după mărimea variaţiei relative a parametrilor de stare, în:
- infinitezimale (variaţia relativă a parametrilor de stare este foarte mică);
- finite (cel puţin un parametru suferă o variaţie finită).
c) după viteza de desfăşurare (natura stărilor intermediare), în:
- cvasistatice (stările intermediare sunt arbitrar de apropiate de stările de echilibru);
- nestatice (stările intermediare nu pot fi complet caracterizate din punct de vedere termodinamic, sistemul nefiind omogen). Numai pentru stările de echilibru termodinamic sunt definiţi parametrii de stare.
Deosebirea dintre aceste două tipuri de procese este dată de timpul de relaxare τ . În procesele cvasistatice variaţia parametrilor este suficient de lentă, aşa încît, prin procese de relaxare, sistemul se poate adapta în fiecare moment noilor condiţii, astfel că stările intermediare prin care trece sistemul pot fi considerate stări de echilibru.
Procesele în care variaţia parametrilor este mare, astfel că stările intermediare nu sunt stări de echilibru, sunt procese nestatice (se reprezintă simbolic printr-o bandă haşurată).
Un proces este considerat cvasistatic dacă timpul caracteristic procesului este mai mare sau egal cu timpul de relaxare (t ≥ τ); dacă însă t < τ procesul este nestatic.
d) după modul în care sistemul poate reveni dintr-o stare finală în starea iniţială, în:
- reversibile, dacă în final sistemul şi mediul înconjurător revin la stările lor iniţiale;
- ireversibile, în caz contrar.
Sensul unui proces poate fi inversat doar în absenţa efectelor disipative (frecare,vâscozitate, histerezis magnetic, rezistenţă electrică etc.). Un proces este reversibil dacă este efectuat cvasistatic (suită de stări de echilibru ce pot fi parcurse în ambele sensuri) şi dacă lipsesc efectele disipative. Toate procesele reale sunt ireversibile. Totuşi, procesele reversibile au o mare importanţă teoretică, fiind cazuri limită la care tind transformările reale nedisipative, atunci când devin foarte lente.
sâmbătă, 1 decembrie 2012
Curiozitati
- Viteza de propagare a durerii în corpul uman este de: 110 m/s.
- Un singur nor de mărime mijlocie, poate atinge 300 000 de t.
- Prima locomotivă cu aburi a atins viteza de 8 km/h . Trenurile moderne călătoresc cu 500 km/h sau chiar 900 km/h .
- Rachetele pot călători cu 40 000 km/h. Aceasta este viteza necesară pentru a scăpa de gravitația terestră și a pătrunde în spațiu. O viteză constantă de 29 000 km/h păstrează racheta pe orbita. Rachetele moderne se folosesc pentru lansarea sondelor si a sateliților spațiali. Racheta este proiectată in spațiu de către trei trepte care ard și se desprind una după alta.
- Nu există aer în spațiul cosmic. Pe măsura ce Pământul rămâne in urma ta, stratul de aer din ce in ce mai subțire. În momentul in care ajungi in spațiul cosmic la o înălțime de 400 km aerul a dispărut cu totul. Spațiul cosmic e un vid. Fragmentele zburătoare pot sa ucidă un astronaut neprotejat dacă până atunci a scăpat de căldura excesiva, frig sau radiații. Este primejdios sa fii acolo sus!
- Poți sări mai sus pe Lună. Când se află pe Lună, astronauții pot să alerge și să sară cu mult mai departe decât pe Pământ. Acest lucru se întâmplă pentru că gravitația este cu mult mai slabă. Când te afli pe Lună, greutatea ta este de șase ori mai mică decât greutatea ta de pe Pământ.
- În 1910 fizicianul francez George Claude inventează lumina de neon.
Abonați-vă la:
Postări (Atom)